- Дисциплина: Химия
- Номер вопроса в билете: 21
- Баллы: 1
- Сложность: Базовый
-
Для выполнения этого задания используйте следующие справочные данные.
Концентрация (молярная, моль/л) показывает отношение количества растворённого вещества (n) к объёму раствора (V).
pH («пэ аш») – водородный показатель; величина, которая отражает концентрацию ионов водорода в растворе и используется для характеристики кислотности среды.
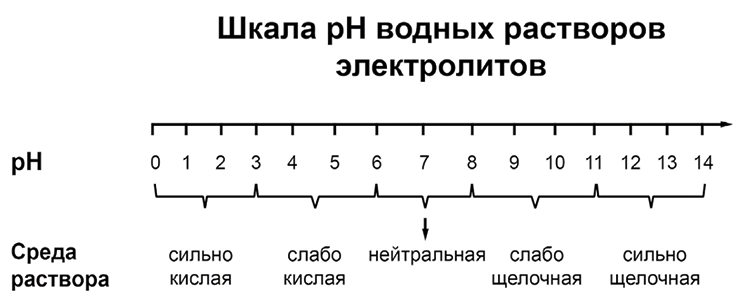
Для веществ, приведённых в перечне, определите характер среды их водных растворов, имеющих одинаковую концентрацию (моль/л).
Запишите номера веществ в порядке возрастания значения pH их водных растворов.
- 1) CrCl2
- 2) CrCl3
- 3) KHCO3
- 4) LiOH
Баллы: 0 - Подробное решение
CrCl2 — соль образована слабым основанием Cr(OH)2 и сильной кислотой HCl, гидролиз по катиону среда слабо кислая pH < 7
CrCl3 — соль образована слабым основанием Cr(OH)3 и сильной кислотой HCl, гидролиз по катиону среда слабо кислая pH < 7
KHCO3 — кислая соль, тот случай когда название соли не отражает её среду. Среда слабо щелочная. Надо запомнить, что гидрокарбонаты имеют щелочную среду. (NaHCO3 KHCO3 LiHCO3) Часть кислых солей имеет кислую среду, а часть щелочную. Почему так? Потому, что водородсодержащий ион (гидрокарбонат ион) одновременно вступает в 2 реакции. В реакцию гидролиз и в реакцию диссоциация (он все еще способен быть донором протона). И так реакция которая идет лучше и определяет среду раствора. Для гидрокарбонат иона (HCO3−) гидролиз идет лучше чем диссоциация, поэтому среда слабощелочная.
Но по причине того, что идет еще и диссоциация, есть небольшое подкисление, среда KHCO3 менее щелочная чем у K2CO3LiOH - сильное основание, среда сильно кислая
Где сложность? Сравнить pH CrCl2 и CrCl3. Cr(ОH)2 более сильное основание чем Cr(ОH)3. Cr(ОH)3 проявляет амфотерные свойства. А это значит что гидролиз по катиону для Cr3+ будет идти лучше чем Cr2+ и среда для CrCl3 будет более кислая чем для CrCl2
Где большая сложность? Надо знать наизусть среды кислых солей (KHCO3 — слабо щелочная, KHSO4 — кислая, KHSO3 — кислая, KH2PO4 — слабо кислая, K2HPO4 — слабощелочная). Сотрудники ФИПИ обещали, что кислых солей в заданиях ЕГЭ не будет. Но верить ли этим обещаниям? Лучше выучить среду кислых солей. Есть еще AgNO3 с нейтральной средой. поскольку Ag2O*H2O - достаточно сильное основание.
В порядке возрастания pH:
CrCl3 (среда слабо кислая) - CrCl2 (среда слабо кислая) - KHCO3 (слабо щелочная) - LiOH (сильно щелочная)
Помоги нам - задонать!