- Дисциплина: Химия
- Номер вопроса в билете: 21
- Баллы: 1
- Сложность: Базовый
-
Для выполнения этого задания используйте следующие справочные данные.
Концентрация (молярная, моль/л) показывает отношение количества растворённого вещества (n) к объёму раствора (V).
pH («пэ аш») – водородный показатель; величина, которая отражает концентрацию ионов водорода в растворе и используется для характеристики кислотности среды.
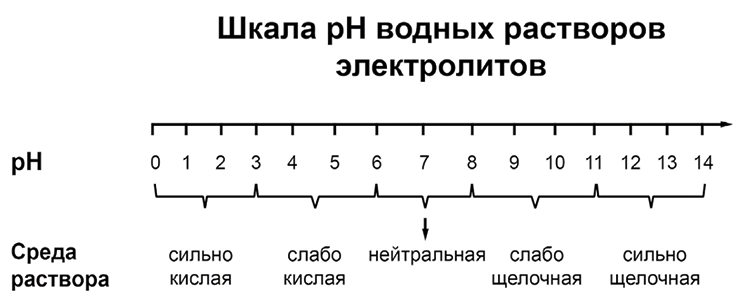
Для веществ, приведённых в перечне, определите характер среды их водных растворов, имеющих одинаковую концентрацию (моль/л).
Запишите номера веществ в порядке возрастания значения pH их водных растворов.
- 1) Na2SO4
- 2) Fe(NO3)2
- 3) K2SO3
- 4) НClO3
Баллы: 0 - Подробное решение
Na2SO4 — соль образована сильным основанием NaOH и сильной кислотой H2SO4 гидролизу не подвергается, полностью диссоциирует на ионы, среда нейтральная. pH=7
Fe(NO3)2 — соль образована слабым основанием Fe(OH)2 и сильной кислотой HNO3 гидролиз по катиону, среда слабокислая. pH<7
K2SO3 — соль образована сильным основанием KOH и слабой кислотой H2SO3 гидролиз по аниону, среда слабощелочная. pH>7
НClO3 — кислота, хлорноватая кислота это сильная одноосновная кислота pH=0-1
Вообще кислота H2SO3 это кислота средней силы, но школьный курс в такие детали не вдается.
В порядке возрастания pH
НClO3 (сильно кислая) - Fe(NO3)2 (слабо кислая) - Na2SO4 (нейтральная) - K2SO3 (слабо щелочная)
Помоги нам - задонать!